Il legame tra proteina Tau e ubiquitina come possibile bersaglio per terapie mirate. Il risultato di una ricerca a cui ha contribuito anche Fondazione Umberto Veronesi
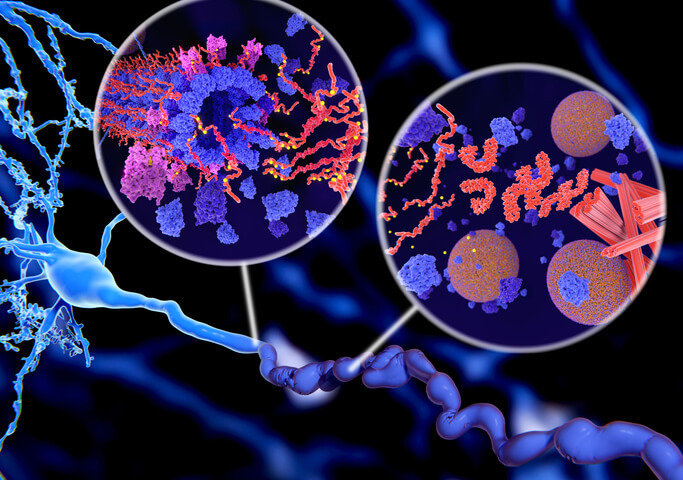
Tau è una proteina che contribuisce al funzionamento dei neuroni nel cervello. Quando non funziona correttamente, forma aggregati e depositi proteici che portano alla morte delle cellule nervose. Ovvero: il prodromo della malattia di Alzheimer. Individuare e comprendere i meccanismi con cui i neuroni cercano di «liberarsi» dagli aggregati di proteina tau permetterà di progettare strategie per combattere la forma più diffusa di demenza senile. Una delle modalità con cui le cellule tentano di eliminare proteine difettose è il legame con l'ubiquitina, una proteina scoperta nel 1975 e oggetto del Premio Nobel per la Chimica assegnato nel 2004 ad Aaron Ciechanover, Avram Hershko e Irwin Rose.
IL RUOLO DELL’UBIQUITINA NELL’ALZHEIMER
Il compito dell'ubiquitina è quello di trasportare le proteine danneggiate al proteasoma, un grosso «macchinario» cellulare capace di distruggerle. Nell'Alzheimer, però, il sistema sembra non funzionare a dovere. Gli aggregati di Tau e ubiquitina si accumulano nei neuroni e arrivano a ostruire il complesso stesso. Per questo lo studio dei due elementi potrebbe tornare utile per mettere a punto una terapia mirata ad aggredire gli aggregati che i neuroni non riescono a smaltire. Una prospettiva che vale la pena di coltivare, sulla base di quanto dimostrato da un gruppo di ricercatori delle Università di Verona e Padova in uno studio pubblicato sulla rivista Angewandte Chemie. Conoscere gli eventi molecolari che portano alla degenerazione dei neuroni è importante per definire strategie terapeutiche per una malattia ancora priva di una cura. E il lavoro degli scienziati veneti è stato utile, in questo senso.
Demenze: cervello più protetto se si parlano più lingue
TAU-UBIQUITINA UN POSSIBILE TARGET TERAPEUTICO?
«Siamo partiti dall’evidenza che, nel tessuto patologico, la proteina Tau è legata all’ubiquitina - dichiara Mariapina D’Onofrio, ricercatrice del dipartimento di biotecnologie dell’ateneo scaligero e coordinatrice del lavoro -. Dopodiché ci siamo chiesti se la sua presenza avesse un impatto nella formazione degli aggregati patologici». Risultato finale: l’ubiquitina ha un ruolo nei processi di neurodegenerazione. Analizzando il complesso con la proteina Tau, si è osservata la tendenza a formare i «grovigli» che impediscono la comunicazione tra i neuroni non è costante, ma varia in base alla posizione in cui l’ubiquitina lega la Tau. «Comprendere i meccanismi molecolari alla base della degenerazione apre la strada all'individuazione di un possibile coinvolgimento della diversa struttura nell’insorgenza e sviluppo della malattia di Alzheimer - aggiunge D'Onofrio -. Questi risultati possono diventare la base per lo sviluppo di nuove strategie farmacologiche che possano usare il sistema ubiquitina Tau come bersaglio».
PERCHE' E' IMPORTANTE TESTARE
I FARMACI SUGLI ANZIANI?
IL RUOLO DI FONDAZIONE UMBERTO VERONESI
Allo studio ha preso parte anche una ricercatrice sostenuta da Fondazione Umberto Veronesi: Francesca Munari, finanziata con un grant nel 2017. È stata lei a mettere nero su bianco i risultati ottenuti in laboratorio. «Sappiamo che la proteina Tau è sottoposta a modifiche chimiche che ne regolano l'attività - afferma la scienziata -. Tuttavia alcune di queste, se presenti in modo anomalo, possono promuovere l'associazione patologica tra diverse macromolecole. Una volta definito come l’ubiquitina altera l'aggregazione della proteina Tau, stiamo lavorando per identificare eventuali cambiamenti nella conformazione del complesso che potrebbero impedirne la rimozione. Il fine ultimo è fornire una base dalla quale partire per definire strategie terapeutiche che mirino a rimuovere gli aggregati tossici e a ristabilire livelli fisiologici di proteina Tau nel tessuto cerebrale».
Fonti

Fabio Di Todaro
Giornalista professionista, lavora come redattore per la Fondazione Umberto Veronesi dal 2013. Laureato all’Università Statale di Milano in scienze biologiche, con indirizzo biologia della nutrizione, è in possesso di un master in giornalismo a stampa, radiotelevisivo e multimediale (Università Cattolica). Messe alle spalle alcune esperienze radiotelevisive, attualmente collabora anche con diverse testate nazionali ed è membro dell'Unione Giornalisti Italiani Scientifici (Ugis).